5 juni 2018
Philips krijgt toestemming van FDA voor zijn MRI-oplossing Ingenia Elition
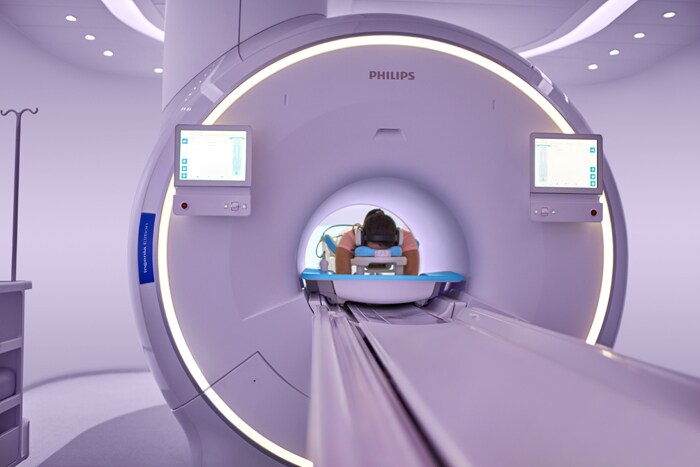
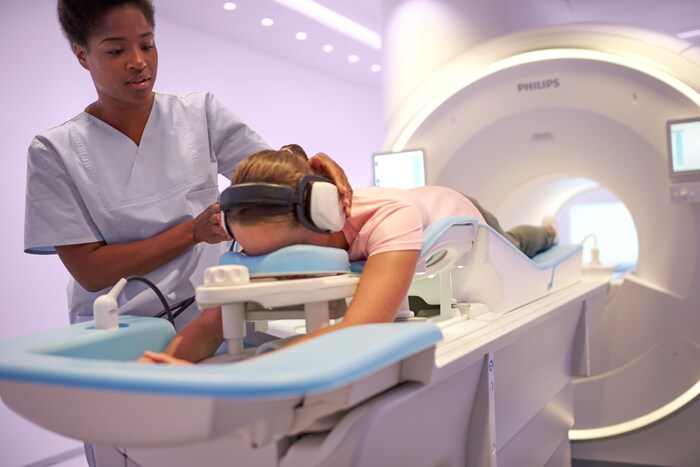
Het Ingenia Elition-systeem van Philips, dat in Amerika voor het eerst op commerciële basis is geïnstalleerd bij Hennepin Healthcare, voert MRI-onderzoek tot wel 50% sneller uit zonder dat dit ten koste gaat van de beeldkwaliteit [1].
Amsterdam – Koninklijke Philips N.V. (NYSE: PHG; AEX: PHIA), een wereldwijde marktleider op het gebied van gezondheidstechnologie, heeft vandaag bekendgemaakt dat het in het kader van de 510(k)-procedure toestemming van de Amerikaanse Food & Drug Administration (FDA) heeft gekregen voor zijn MRI-oplossing Ingenia Elition 3.0T en voor twee klinische applicaties, Compressed SENSE en 3D APT. Deze geïntegreerde reeks van innovaties stelt medici in staat om onderzoek tot wel 50% sneller uit te voeren [1], met meer vertrouwen diagnoses te stellen en de patiëntervaring te verbeteren. Het Ingenia Elition-systeem van Philips is onlangs voor het eerst in de VS op commerciële basis geïnstalleerd bij Hennepin Healthcare, een grote zorgorganisatie in Minneapolis. “De combinatie van Ingenia Elition en onze nieuwe klinische applicaties maakt het produceren van hoogwaardige beelden snel en eenvoudig. Dit maakt het mogelijk om direct diagnoses te stellen en dit draagt bij aan een effectieve behandeling”, aldus Arjen Radder, Global Business Leader voor MRI bij Philips. “Naarmate we het volledig nieuwe Ingenia-portfolio voor digitaal MRI-onderzoek verder uitrollen, krijgen we zeer positieve reacties van onze klanten. Dit portfolio biedt zorgorganisaties als Hennepin Health innovatieve oplossingen die gegevens, technologie en mensen naadloos met elkaar verbinden om zo zorg van de hoogste kwaliteit mogelijk te maken.” In het hedendaagse zorglandschap – waarin vergoedingen steeds vaker op gerealiseerde waarde worden gebaseerd en chronische aandoeningen tot meer MRI-procedures en langere wachttijden leiden – komt steeds meer druk te staan op de radiologie-afdeling. Philips beantwoordt deze uitdagingen door nieuwe systemen en klinische applicaties te ontwikkelen die voor een hogere beeldkwaliteit zorgen, de ervaring voor patiënten en personeel verbeteren en de operationele efficiëntie bevorderen.
Ingenia Elition van Philips speelt een cruciale rol bij het verhogen van de zorgstandaard voor onze patiënten op het gebied van beeldvorming en bij het verbeteren van de algehele bedrijfsvoering in ons nieuwe beeldvormingscentrum.
Dr. Chip Truwit
MD, directeur van de afdeling Radiologie van Hennepin Healthcare.
“Om snelle, consistente en nauwkeurige diagnoses te kunnen stellen moet ons personeel ondersteund worden met technologie die hen de mogelijkheid biedt om de beste zorg aan de patiënt te leveren, op een efficiënte en kosteneffectieve manier”, aldus dr. Chip Truwit MD, directeur van de afdeling Radiologie van Hennepin Healthcare. “Ingenia Elition van Philips speelt een cruciale rol bij het verhogen van de zorgstandaard voor onze patiënten op het gebied van beeldvorming en bij het verbeteren van de algehele bedrijfsvoering in ons nieuwe beeldvormingscentrum.”
Meer diagnostische zekerheid en een betere patiëntervaring
Ingenia Elition en het gehele Philips-portfolio voor digitaal MRI-onderzoek maken een snellere, slimmere en eenvoudigere route naar diagnose mogelijk en bieden patiënten en radiologen de volgende voordelen.
Volledig nieuw Ingenia-portfolio voor digitaal MRI-onderzoek
Ingenia Elition maakt deel uit van het volledig nieuwe Ingenia-portfolio van Philips voor digitaal MRI-onderzoek dat radiologie-afdelingen ondersteunt om de productiviteit te verhogen, de ervaring voor patiënten en medewerkers te verbeteren en betere, op gerealiseerde waarde gebaseerde zorg te leveren door middel van verbeterde patiëntresultaten en lagere kosten. Ingenia Elition 3.0T is al verkrijgbaar in Europa. [1] Met behulp van Compressed SENSE-technologie en vergeleken met Philips-scans zonder deze technologie. [2] SmartExam is niet beschikbaar voor patiënten met implantaten waarbij MRI-scans onder voorbehoud zijn (zgn. ‘MR Conditional’-implantaten). [3] Togao et al. (2014). Neuro-Oncology. [4] Park, K.J., et al. (2016). European Radiology. [5] Resultaten van onderzoekscasussen hebben geen voorspellende waarde voor resultaten van andere casussen. Resultaten van andere casussen kunnen afwijken. [6] Vergeleken met het gemiddelde van de overige vijf Philips MRI-scanners zonder Ambient Experience en de ‘In Bore Connect’-oplossing. Resultaten van onderzoekscasussen hebben geen voorspellende waarde voor resultaten van andere casussen. Resultaten van andere casussen kunnen afwijken. [7] Op basis van interne tests.
Over Koninklijke Philips N.V.
Koninklijke Philips N.V. (NYSE: PHG; AEX: PHIA) is een toonaangevende aanbieder van gezondheidstechnologie die zich richt op het verbeteren van de gezondheid van mensen en het bereiken van betere zorgresultaten binnen het gehele gezondheidscontinuüm, van gezond leven en preventie tot diagnostiek, behandeling en thuiszorg. Philips maakt gebruik van geavanceerde technologieën en diepgaand inzicht in klinische toepassingen en de behoeften van consumenten om geïntegreerde oplossingen te ontwikkelen. Het hoofdkantoor van Philips is gevestigd in Nederland. De onderneming is marktleider op het gebied van diagnostische beeldvorming, beeldgestuurde behandelingen, medische IT toepassingen, patiëntbewaking, thuiszorgsystemen en gezondheidstoepassingen voor consumenten. Met wereldwijd circa 74.000 medewerkers en verkoop- en servicepunten verspreid over meer dan 100 landen genereerden de activiteiten op het gebied van gezondheidstechnologie in 2017 een omzet van 17,8 miljard euro. Voor nieuws over Philips kunt u terecht op www.philips.com/newscenter.
Onderwerpen
Contact

Mark Groves
Philips Global Press Office Tel.: +31 631 639 916
You are about to visit a Philips global content page
ContinueMedia assets
The Philips Ingenia Elition 3.0T MR and two clinical applications, Philips Compressed SENSE and 3D APT, now have U.S. FDA 510(k) clearance
Hennepin Healthcare in Minneapolis has first U.S. commercial installation of the Philips Ingenia Elition 3.0T MR