mei 16, 2023
Philips geeft update over afgeronde set tests voor CPAP/BiPAP slaapapneu-apparaten
Amsterdam, Nederland – Royal Philips (NYSE: PHG; AEX: PHIA) geeft vandaag een update over het uitgebreide test- en onderzoeksprogramma van haar dochteronderneming Philips Respironics. De onderzoeken zijn uitgevoerd naar aanleiding van de vrijwillige veiligheidsmelding* in juni 2021, vanwege mogelijke gezondheidsrisico’s van het op polyester gebaseerde polyurethaan (PE-PUR) geluiddempende schuim in bepaalde slaapapneu- en beademingsapparaten.
De risicobeoordelingen zijn nu afgerond voor de CPAP/BiPAP slaapapneu-apparaten die onder de veiligheidsmelding* vallen, i.e., de eerste generatie DreamStation, System One en DreamStation Go apparaten. Samen vertegenwoordigen deze apparaten ongeveer 95% van de geregistreerde apparaten wereldwijd. De tests en beoordelingen bouwen voort op de eerdere updates in december 2021, juni 2022 en december 2022. Daarnaast zijn tests en analyses afgerond voor eerste generatie DreamStation-apparaten die zijn blootgesteld aan reiniging met ozon.
Testmethoden
Het test- en onderzoeksprogramma is uitgevoerd in samenwerking met vijf onafhankelijke, gecertificeerde testlaboratoria. De resultaten zijn bekeken en beoordeeld door gekwalificeerde, externe deskundigen en Philips Respironics, alsmede door een extern medisch panel.
De toegepaste testmethoden - bestaande uit testplanning, testuitvoering en interpretatie van de resultaten - zijn in overeenstemming met de van toepassing zijnde ISO 18562 [1,2] en ISO 10993 [3] normen. De opzet van de toegepaste testmethoden is wetenschappelijk onderbouwd rekening houdend met de beperkingen die inherent zijn aan het doen van onderzoek. Zo zijn er tests uitgevoerd op meerdere gebruikte apparaten met een verschillende mate van gebruik door patiënten en waargenomen visuele degradatie van het schuim, en op laboratoriumschuim dat opzettelijk in verschillende mate is aangetast. Bij de risicobeoordelingen is uitgegaan van zeer conservatieve aannames. Meer voorbeelden vindt u onderaan dit persbericht.
"Onze eerste prioriteit is de gezondheid en het welzijn van patiënten", aldus Roy Jakobs, CEO van Koninklijke Philips. "We hebben ons daarom gericht op het uitgebreide test- en onderzoeksprogramma om meer duidelijkheid over de veiligheid van de betrokken apparaten te verkrijgen. Daarnaast hebben wij ons ingezet om zo snel mogelijk vervangende apparaten voor patiënten te leveren. De vandaag gepresenteerde risicobeoordelingen van externe experts voor de slaapapneu-apparaten zijn positief en geruststellend, en we maken goede vorderingen met het vervangen van de apparaten. De relevante bevoegde autoriteiten wereldwijd, waaronder de FDA, zijn de testresultaten en beoordelingen nog aan het bestuderen. Wij werken nauw samen met deze instanties, we hebben ten slotte dezelfde doestelling: de veiligheid van de patiënt en de kwaliteit van de gezondheidszorg waarborgen. De afronding van de tests en de vervanging van de betrokken apparaten blijven onze hoogste prioriteiten."
Testresultaten en analyses voor slaapapneu-apparaten – niet blootgesteld aan ozonreiniging
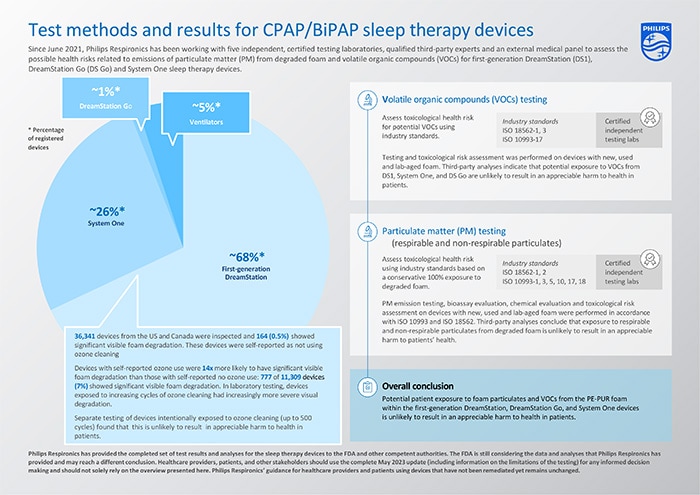
De afgeronde reeks testresultaten en analyses voor de eerste generatie DreamStation, System One en DreamStation Go slaapapneu-apparaten, laten zien dat het onwaarschijnlijk is dat mogelijke blootstelling van patiënten aan zwevende deeltjes (PM) en vluchtige organische stoffen (VOC) uit het PE-PUR-schuim in deze apparaten tot gezondheidsschade bij patiënten leidt. De resultaten vallen binnen internationaal aanvaarde veiligheidsmarges voor impact op de gezondheid. De uitgevoerde tests en conclusies zijn samengevat in onderstaande tabel.
VOC: Volatile Organic Compounds - Vluchtige Organische Stoffen
PM: Particulate Matter - Zwevende deeltjes
* De totale hoeveelheid schuim in de toestellen varieert van ongeveer 1 g tot 10 g, afhankelijk van het luchtpadontwerp en de configuratie van het toestel. Alle modellen binnen hetzelfde platform hebben hetzelfde luchtpadontwerp en dezelfde configuratie, inclusief de aanwezige hoeveelheid schuim.
** Het schuim van 7 verschillende gebruikte eerste generatie DreamStation-apparaten werd chemisch gekarakteriseerd volgens ISO 10993-18 en -17 [3] en bevatte schuim dat verschillende stadia van degradatie liet zien.
Uitgebreide tests en toxicologische risicobeoordelingen, uitgevoerd op meerdere apparaten met nieuw, gebruikt en in het lab verouderd schuim en op basis van ISO 18562-3 [2] testen, tonen aan dat het risico op gezondheidsschade voor de gedetecteerde VOC’s onwaarschijnlijk is. Ook een risicobeoordeling door derden concludeerde dat het onwaarschijnlijk is dat blootstelling aan VOC's voor deze apparaten zal leiden tot gezondheidsschade bij patiënten.
Nieuwe, gebruikte en in het lab verouderde apparaten werden getest en voldeden allemaal aan de ISO 18562-2 [1] toegestane grenswaarden voor deeltjesemissies. Er werden tests uitgevoerd op gebruikte apparaten (apparaten die eerder door patiënten werden gebruikt) met verschillende stadia van degradatie (van geen degradatie tot ernstige degradatie), nieuwe apparaten en apparaten met in het lab verouderd schuim dat opzettelijk werd blootgesteld aan aanzienlijk verhoogde temperaturen (≥80°C) en luchtvochtigheid (≥75% RH) om de degradatie te versnellen.
Zelfs in de zeer conservatieve en theoretische veronderstelling dat al het schuim afbreekt en dat een patiënt vervolgens wordt blootgesteld aan al het afgebroken PE-PUR-schuim in de apparaten, wordt in de risicobeoordeling door derden geconcludeerd dat het onwaarschijnlijk is dat blootstelling aan deeltjes van afgebroken schuim in deze apparaten, met inbegrip van potentiële inhaleerbare en niet-inhaleerbare deeltjes, tot gezondheidsschade bij patiënten leidt.
Op basis van de visuele inspectie van het schuim in geretourneerde eerste generatie DreamStation-apparaten bleek de prevalentie van zichtbare schuimafbraak laag te zijn. Visuele inspectie kan alleen zichtbare schuimdegradatie vaststellen. Deze methode meet geen vluchtige organische stoffen en kan de uitstoot van schuimdeeltjes niet kwantificeren. Daarom zijn aanvullende tests en analyses uitgevoerd zoals hierboven en in de volledige testupdate beschreven.
De invloed van ozonreiniging op de degradatie van PE-PUR-schuim in eerste generatie DreamStation-apparaten
Philips Respironics heeft tests afgerond op de eerste generatie DreamStation-apparaten die aan ozonreiniging zijn blootgesteld.
ISO 18562-3 VOC-tests toonden aan dat na 200 ozonreinigingscycli - waarbij elke cyclus een nacht van gebruik en vervolgens reiniging met ozon simuleert – di-ethyleenglycol (DEG) detecteerbaar werd als VOC. De tests werden uitgevoerd tot 500 reinigingscycli met ozon. Een VOC-toxicologisch risico van deze door ozon veroorzaakte afbraak toonde aan het onwaarschijnlijk is dat blootstelling aan VOC-emissies van de beoordeelde eerste generatie DreamStation-apparaten die met ozon zijn behandeld, tot een gezondheidsrisico voor patiënten leidt.
Er zijn tests uitgevoerd naar de risico’s die verband houden met inhaleerbare en niet-inhaleerbare deeltjes. Deze tests zijn uitgevoerd op apparaten waarvan bekend is dat zij aan ozon zijn blootgesteld. Zo zijn twee gebruikte eerste generatie DreamStation-apparaten van met door de gebruiker gemelde blootstelling aan ozon opgenomen in de tests op extractables en leachables, die de basis vormden voor een toxicologische risicobeoordeling van de deeltjes uit PE-PUR-schuim van de slaapapneu-apparaten. De conclusie van de collectieve analyse door derden luidde dat het onwaarschijnlijk is dat blootstelling aan deeltjes van afgebroken schuim in de eerste generatie DreamStation-apparaten tot gezondheidsschade bij patiënten leidt.
Zoals eerder gepubliceerd, laten de gegevens voor de eerste generatie DreamStation zien dat apparaten met door de gebruiker gerapporteerde ozonreiniging 14 keer meer kans hebben op significante, zichtbare schuimafbraak/volumevermindering in vergelijking met apparaten zonder door de gebruiker gerapporteerde blootstelling aan ozon. Deze constatering komt overeen met laboratoriumtests, waarbij de eerste generatie DreamStation apparaten die aan steeds meer reinigingscycli met ozon werden blootgesteld, een steeds ernstigere visuele degradatie vertoonden. Zoals hierboven geconcludeerd is het echter onwaarschijnlijk dat dit tot gezondheidsschade bij patiënten leidt.
Overzicht van lopende tests
Philips Respironics is bezig met de afronding van diverse resterende tests. De risicobeoordelingen voor System One en DreamStation Go apparaten (die hetzelfde schuim bevatten als de eerste generatie DreamStation apparaten) die met ozon zijn behandeld, worden momenteel afgerond. Voor de Trilogy 100/200 en OmniLab Advanced Plus beademingsapparaten worden de VOC- en PM-tests voortgezet, evenals de chemische evaluatie en toxicologische risicobeoordeling. Deze apparaten bevatten een ander type PE-PUR-schuim dan de eerste generatie DreamStation-apparaten [5]. Philips Respironics verwacht hierover in het derde kwartaal van 2023 een update te geven.
Richtlijn voor zorgverleners en patiënten
Patiënten die momenteel een betrokken slaapapneu-apparaat gebruiken dat nog niet is gerepareerd of vervangen en nog niet is geregistreerd, wordt verzocht hun apparaat alsnog te registreren.
Philips Respironics blijft patiënten met betrokken slaapapneu-apparaten die nog niet zijn vervangen, adviseren met hun arts of zorgverlener te overleggen over het voorzetten van hun behandeling. Zo kan ervoor worden gekozen om te stoppen met het gebruik van het apparaat, om het apparaat te blijven gebruiken, om een vergelijkbaar apparaat te gebruiken dat geen onderdeel is van de veiligheidsmelding of om over te stappen op een alternatieve behandeling voor slaapapneu. Bovendien wordt patiënten geadviseerd de instructies en aanbevolen reinigings- en vervangingsrichtlijnen van Philips Respironics voor hun slaapapneu-apparaat en accessoires op te volgen. Reinigingsmiddelen met ozon en UV-licht zijn momenteel geen goedgekeurde reinigingsmethoden voor slaapapneu-apparaten of maskers en mogen niet worden gebruikt.
Philips Respironics blijft ook gebruikers van beademingsapparatuur adviseren contact op te nemen met hun zorgverleners voordat zij hun therapie wijzigen.
Wetenschappelijke onderbouwing van de testmethoden
De opzet van de toegepaste testmethoden is wetenschappelijk onderbouwd op basis van een grondige overweging en met inachtneming van de testbeperkingen die inherent zijn aan elke testnorm en/of wetenschappelijk onderzoek. Ter illustratie worden hieronder voorbeelden gegeven van dergelijke overwegingen en beperkingen.
De opzet van de toegepaste testmethoden is wetenschappelijk onderbouwd rekening houdend met de beperkingen die inherent zijn aan het doen van onderzoek, bijvoorbeeld:
* Vrijwillige terugroepactie in de VS/veiligheidsmelding voor de rest van de wereld.
[1] ISO 18562-2: Biocompatibiliteitsbeoordeling van luchtpadontwerp in gezondheidstoepassingen - Deel 2: Testen voor PM-emissies.
[2] ISO 18562-3: Biocompatibiliteitsbeoordeling van luchtpadontwerp in gezondheidstoepassingen - Deel 3: Testen voor VOC-emissies.
[3] ISO 10993: Biologische evaluatie van medische hulpmiddelen; Deel 1: Evaluatie en testen binnen een riskmanagementproces; Deel 3: Testen voor genotoxiciteit, carcinogeniteit en voortplantingstoxiciteit; Deel 5: Testen voor in vitro cytotoxiciteit; Deel 10: Testen voor irritatie en huidsensibilisatie; Deel 17: Vaststelling van toelaatbare grenzen voor leachable stoffen; Deel 18: Chemische karakterisering van materialen voor medische hulpmiddelen binnen een risicobeheerproces.
[4] De standaard die werd gebruikt voor testen voorafgaand aan ISO 18562.
[5] Eerste generatie DreamStation, SystemOne en DreamStation Go toestellen bevatten PE-PUR-schuim van type A. Trilogy 100/200 toestellen bevatten PE-PUR-schuim van type B en OmniLab Advanced Plus toestellen bevatten PE-PUR-schuim van type A en type B. De bekende verschillen tussen het schuim van type A en type B, zijn dat schuim van type B: kan worden gebruikt met een acryl drukgevoelige lijm, een lagere dichtheid heeft, een andere dikte heeft en ook een toevoeging bevat om de mogelijke ontvlambaarheid te verminderen.
Over Koninklijke Philips N.V.
Koninklijke Philips N.V. (NYSE: PHG; AEX: PHIA) is een toonaangevende aanbieder van gezondheidstechnologie die zich richt op het verbeteren van de gezondheid van mensen en het bereiken van betere zorgresultaten binnen het gehele gezondheidscontinuüm, van gezond leven en preventie tot diagnostiek, behandeling en thuiszorg. Philips maakt gebruik van geavanceerde technologieën en diepgaand inzicht in klinische toepassingen en de behoeften van consumenten om geïntegreerde oplossingen te ontwikkelen. De onderneming is marktleider op het gebied van diagnostische beeldvorming, beeldgestuurde behandelingen, medische IT-toepassingen, patiëntbewaking, thuiszorgsystemen en gezondheidstoepassingen voor consumenten. Het hoofdkantoor van Philips is gevestigd in Nederland. Met wereldwijd circa 74.000 medewerkers en verkoop- en servicepunten verspreid over meer dan 100 landen genereerden de activiteiten op het gebied van gezondheidstechnologie in 2022 een omzet van 17,8 miljard euro. Voor nieuws over Philips kunt u terecht op www.philips.nl.
Forward-looking statements
This statement contains certain forward-looking statements with respect to the financial condition, results of operations and business of Philips and certain of the plans and objectives of Philips with respect to these items. Examples of forward-looking statements include statements made about the strategy, estimates of sales growth, future EBITA, future developments in Philips’ organic business and the completion of acquisitions and divestments. By their nature, these statements involve risk and uncertainty because they relate to future events and circumstances and there are many factors that could cause actual results and developments to differ materially from those expressed or implied by these statements.
Topics
Contacts

Steve Klink
Philips Global Press Office Tel: +31 6 10888824
You are about to visit a Philips global content page
Continue
Elco van Groningen
Philips Global External Relations
You are about to visit a Philips global content page
ContinueBeeldmateriaal